Si tratta di una patologia considerata rara, ma in Letteratura esistono numerosi articoli sull’argomento. Il primo caso sembra sia da attribuirsi a A. Lambert nel 1898 (rif Chong). Si tratta solitamente di “case reports”. Una ingestione di corpi estranei (CE) è abbastanza frequente ma complicanze si avrebbero solo nell’1% dei casi (Goncalves, Carver, Bostanci).

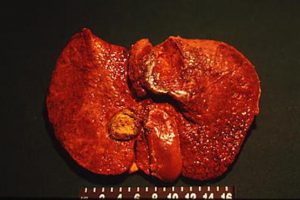
Gli ascessi epatici sono complicanze di bassa incidenza (2.3/100000/anno – Barquez) dovuti a varie eziologie quali chirurgiche, traumatiche, parassitarie etc). La mortalità per ascesso epatico si situerebbe tra il 2-12% (Basquez).
I sintomi, che possono comparire anche mesi dopo l’ingestione di un CE (Carver, Bostanci), sono dati da dolore in ipocondrio destro, febbre (Chong), leucocitosi (Basquez), innalzamento della fosfatasi alcalina, a volte ittero.
La eziologia ascessuale da CE riguarda solitamente pazienti in età medio-avanzata (Basquez, Goncalves, Chong, Jutte) ma non solo (Carver, Bostanci); la causa è dovuta, in frequenza decrescente (Chong), a spine di pesce (Goncalves), stuzzicadenti (Chong), ossa di pollo ed aghi da cucito (Basquez, Carver). In un pubblicazione del 2019 si segnalavano 62 casi in Letteratura di perforazioni dovute a spine di pesce (Goncalves). 23 casi venivano riportati sino al 2019 come dovuti ad aghi da cucito (Bostanci).

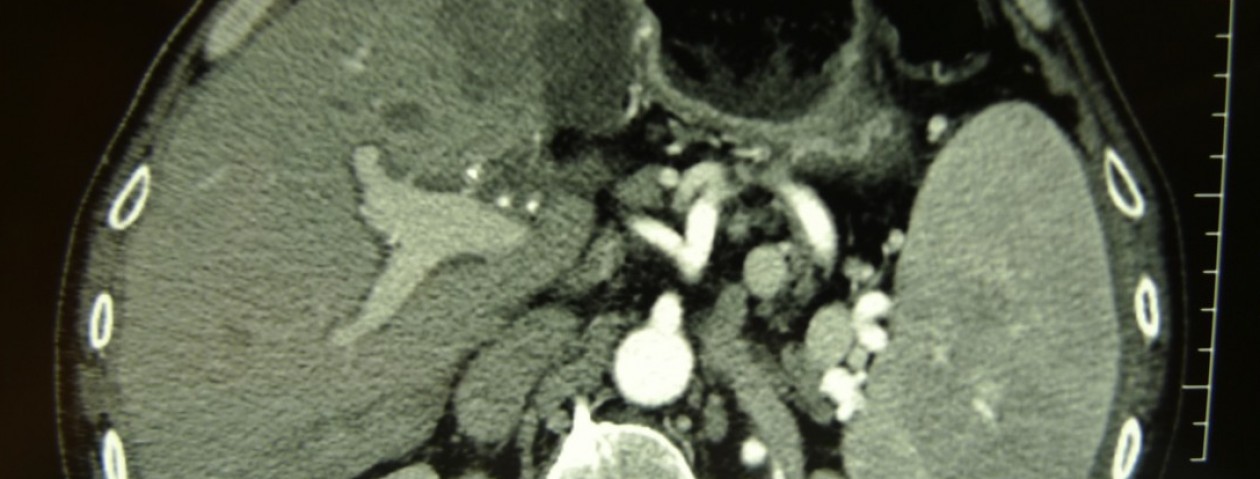
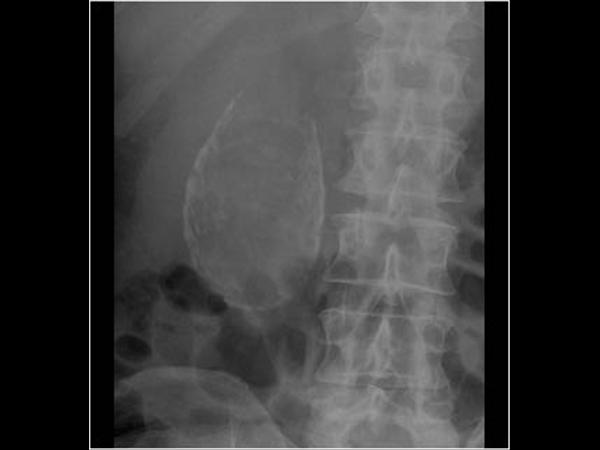
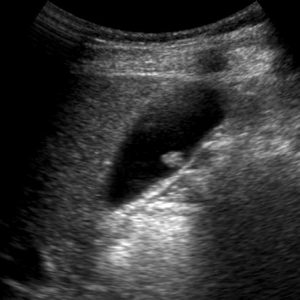
La diagnosi pretrattamento è oggi più frequente e secondaria solitamente ad una TAC addominale (Basquez, Goncalves, Carver, Chong). La perforazione risiede spesso a livello gastrico all’antro (Basquez, Chong) o a livello duodenale e colico (Chong). La sede dell’ascesso, di dimensioni variabili (circa 4 cm sec Basquez, 7 cm sec Chong) interessa spesso il lobo sinistro epatico (Basquez, Goncalves, Carver, Chong). Comunque, un corpo estraneo ed un ascesso possono localizzarsi per perforazione gastrica anche nel lobo epatico destro (Bostanci, Chong).
Uno studio di Chong su 88 casi in Letteratura riporta una unica eziologia ascessuale batterica nel 54,5% dei casi; i germi più spessi identificati erano lo Str.species (72.3%), E.Coli (17%) e Klebsiella pneumoniae (10,6%); Secondo altri Autori l’agente batterico riscontrato erano uno Streptococcus Viridans (Basquez), Str. Anginosus e Eikenella Corrodens (Goncalves) (due batteri dell’orofaringe) oppure Gram neg quali E.Coli, K Pneumoniae ed anaerobi.
Il trattamento è legato alla eziologia ed al numero e dimensioni degli ascessi. Comprende in genere l’uso precoce di antibiotici inizialmente ad ampio spettro (piperacillin-tazobactam e metronidazolo sec Goncalves;) o cefalosporine di seconda generazione (Cefoxitina)(Chong) e poi mirato dopo puntura esplorativa percutanea (Goncalves); Chong utilizza nel suo Case Report Cefriaxone e Metronidazolo e quindi levofloxacina dopo la dimissione.
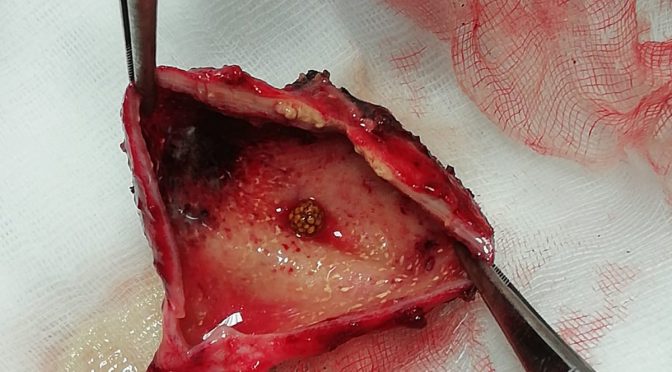
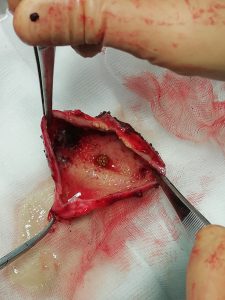
Un trattamento chirurgico è più spesso laparotomico (Basquez) o laparoscopico; si procede al drenaggio dell’ascesso (Jutte), alla asportazione del CE (Jutte e poi Carver, e Bostanci in laparoscopia in assenza di ascesso) ed eventualmente alla riparazione della perforazione gastrica se evidente (a volte si usa il blue di metilene); eventualmente se non evidenti perforazioni può essere sufficiente una omento plastica (Goncalves).
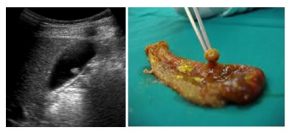
L’asportazione del CE sembra sarebbe importante per evitare recidive ascessuali (Goncalves, Chong). A volte risulta possibile per via endoscopica (Chong); La localizzazione del CE, se all’interno del fegato a volte necessita di una fluoroscopia intraoperatoria e quindi di una incisione laparoscopica del parenchima (Bostanci).

Per quanto riguarda l’ascesso, questo può non essere drenato ma trattato semplicemente con antibiotici (Chong); un drenaggio dell’ascesso può essere effettuato per via percutanea (Goncalves), mentre un approccio di drenaggio chirurgico, preferibile per una successiva degenza ospedaliera più breve secondo Chong, è indicato nei casi di ascessi multiloculari (Basquez).
Basquez, DOI: 10.7759/cureus.8924
Chong, doi:10.3748/wjg.v20.i13.3703
Carver, doi.org/10.1016/j.ijscr.2018.09.012
Jutte, DOI 10.1100/tsw.2010.142
Bostanci, doi: 10.5505/tjtes.2016.48995
Goncalves, DOI: 10.1159/000497333