Esistono diversi articoli sulla definizione e sulla diagnosi precoce delle fistole pancreatiche dopo DPC (POPF=post-operative pancreatic fistula). Ne esistono meno, riguardanti i dettagli nella diagnosi radiologica e soprattutto sul trattamento di una deiscenza dell’anastomosi pancreatico digiunale.
L’incidenza sembra situarsi tra il 3-12% nelle DPC (4,6,7) ma appare variabile; più bassa nei casi di pancreatite cronica (0-5%), più elevata in caso di pancreas soffici (sino al 16%)(4).
La definizione di una fistola pancreatica è ormai ben codificata dall’International Study Group on Pancreatic Fistula e riportata ancora da Bassi (1). Consiste nella presenza nei drenaggi, dalla terza giornata postoperatoria, indipendentemente dalla quantità di volume del liquido, di un contenuto di amilasi superiore di almeno 3 volte il normale valore di amilasi nel plasma. Una volta definita la presenza di una fistola il grading viene effettuato i base a 9 criteri clinici: le condizioni del paziente, trattamenti specifici, reperti ecografici e TAC, la persistenza oltre 3 settimane, reinterventi, segni di infezione, sepsi etc (9); Si distinguono quindi clinicamente POPF di grado A, B e la più grave, necessitante un intervento chirurgico per un quadro di sepsi, di grado C. In prima giornata postoperatoria invece, rilevare un a concentrazione di amilasi > 5000 permette di identificare i pazienti a rischio di fistola.
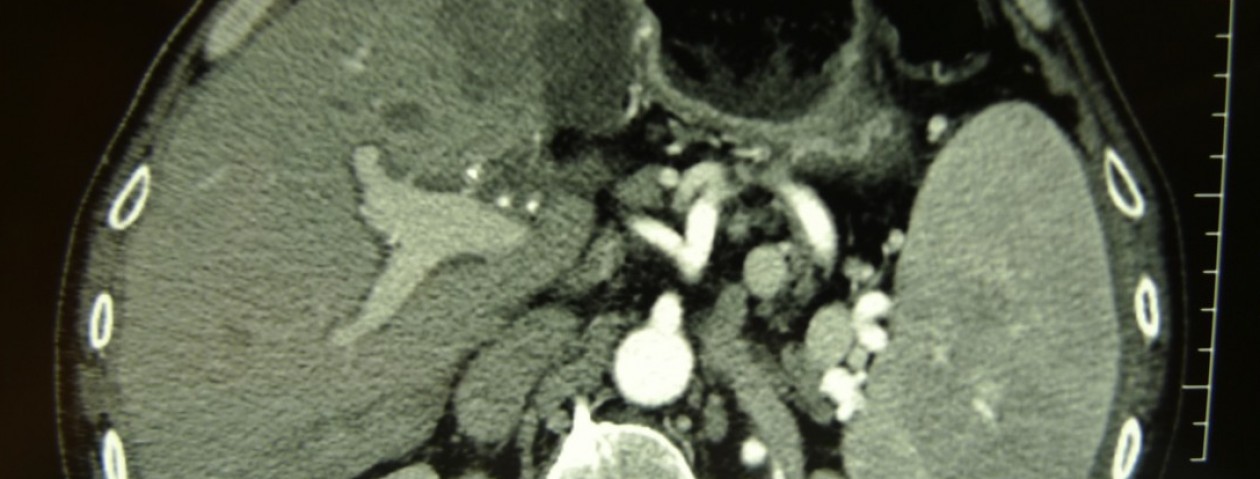
La diagnosi radiologica, ritenuta poco importante sino a pochi anni fa (1), oggi, riportata dai diversi autori, consiste per alcuni nella evidenza alla TAC, intorno alla anastomosi pancreatico digiunale, di liquido (9) a volte con bolle d’aria (2). Alcuni sottolineano l’importanza diagnostica di una fistolografia attraverso i drenaggi posti in sede intraoperatoria (9). Altri autori sottolineano la possibile presenza alla TAC di un “gap” cioè un difetto, tra il pancreas e l’ansa digiunale (3).
La terapia delle fistole di grado C può essere variabile; alcuni (6) suggeriscono il posizionamento percutaneo di drenaggi multipli, posti il più possibile in vicinanza della fistole ed anche utilizzando i tramiti dei precedenti drenaggi (6), con la speranza di ottenere un drenaggio esterno della fistola evitando così l’erosione di strutture circostanti; in situazioni di emodinamica instabile e di evidenza alla TAC di deiscenza (3) alcuni suggeriscono un intervento chirurgico (nel 5-20% dei casi secondo Ryska) tramite: A) il posizionamento chirurgico di drenaggi multipli; oppure B) la trasformazione della anastomosi pancreatico digiunale in una pancreatico gastrica; C) l’abolizione della anastomosi pancratico digiunale senza una nuova anastomosi. D) una pancreasectomia totale (2,5) che comporta però una mortalità molto elevata. Alcuni autori recentemente (3) suggeriscono E) una tecnica con stent a ponte consistente nel posizionare uno stent di 6-8 fr nel wirsung da un lato ivi fissandolo e nell’ansa digiunale dall’altro, con una borsa di tabacco intorno. Altri ancora riferiscono la possibilità di F) resecare l’ansa digiunale deiscente e di occludere il moncone pancratico (8).
Bibliografia
1) Bassi C: Surgery 2005;138:8-13
2) Bassi C: J Hepatobiliary Pancreat Surg (2008) 15:247–251
3) TS Kent: HPB 2010, 12, 577–582
4) Hackert T: The surgeon n.9 (2011), 211-7
5) Machado NO: International Journal of Surgical Oncology, Volume 2012, Article ID 602478, 10 pages, doi:10.1155/2012/602478.
6) Pedrazzoli S: Annals of Surgery • Volume 249, Number 1, January 2009
7) El Nakeeb A: World J Surg (2013) 37:1405–1418
8) Ryska M: Hepatobiliary Surg Nutr 2014;3(5):268-275
9) Malleo G: Langenbecks Arch Surg. 2014 Oct;399(7):801-10